FÍSICA II :
En este primer curso de Física II se pudieron apreciar los siguientes Temas Relacionados con los siguientes cuatro puntos :
- Espacio
- Materia
- Energía
- Tiempo.
Analicemos este Primer Tema:
CALOR, TEMPERATURA Y DILATACIÓN
ENERGIA TERMICA (CALOR)
Energía Interna ( U ) : Es la energía total de las partículas que lo constituyen, es decir, la suma de todas las formas de energía que poseen sus partículas; átomos, moléculas e iones.
Temperatura ( T ) : Es una medida de la energía cinética media de las partículas de un cuerpo, de modo que un cuerpo está a mayor temperatura que otro si la energía cinética media de sus partículas es mayor.
- Termómetros : Miden la temperatura
- Escalas de Temperatura : Celsius ( Tc )
Kelvin ( T )
Fahrenheit ( Tf )
Equivalencias :
Tc / 5 = Tf - 32 / 9
T = Tc + 273
Calor : La energía transferida entre dos cuerpos debido a una diferencia de temperatura se denomina Calor o Energía Térmica.
* Formas de transferencia del calor : Conduccíon
Convección
Radiacción
Efectos del Calor :
- Aumento de la temperatura
- Cambio del estado de agregacion
- Dilatacion del cuerpo
Q = m Ce ( tf - to )
Ce = Calor especifico ( calor que debe recibir la unidad de masa para que aumente su temperatura 1ºC )
* Q = Julios * Ce = Julio / Kg ºK
Equilibrio Térmico : Cuando dos cuerpos con distintas temperaturas se ponen en contacto, llega un momento en el que estas temperaturas se estabilizan, a eso se le denomina "Equilibrio Térmico"
- Calor cedido = Calor Ganado
Qa = Qb
Ca Ma ( ta - t ) = Cb Mb ( t - tb )
Cambios de Estado :
- Fusión : SOLIDO A LIQUIDO
- Vaporización : LIQUIDO A GAS
- Condensación : GAS A LIQUIDO
- Calor de fusión :
Q = m Lf
Q = m Cv
* Lf = Calor de fusión * Cv = Calor de Vaporización
DILATACION TERMICA EN CUERPOS CON ESTADO SOLIDO
Dilatación Lineal : El incremento que experimenta la unidad de longitud al aumentar 1 ºC su temperatura, se denomina " Coeficiente de Dilatación Lineal ".
L = Lo ( 1 + £ At )
L = Longitud final
Lo = Longitud inicial
£ = Coeficiente de Dilatación Líneal
At = incremento de temperatura = (tf - to)
Dilatación Superficial : El incremento que experimenta la unidad de superficie al aumentar 1 ºC su temperatura se denomina " Coeficiente de dilatación superficial ".
S = So ( 1 + ß At )
S = Superficie final
So = Superficie inicial
ß = Coeficiente de Dilatación Superficial ( aproximadamente igual a 2 £ )
At = Incremento de temperatura = (tf - to)
Dilatación Cúbica : El incremento que experimenta la unidad de volumen al aumentar 1ºC su temperatura se denomina " Coeficiente de Dilatación Cúbica "
V = Vo ( 1 + y At )
V = Volumen final
Vo = Volumen inicial
y = Coeficiente de Dilatación Cúbica
At = Incremento de temperatura = (tf - to)
DILATACION TERMICA EN CUERPOS CON ESTADO LIQUIDO
Dilatación Liquida : La dilatación de los líquidos es similar a la dilatación cúbica de los sólidos, por tanto, depende del incremento de temperatura y de la naturaleza del líquido.
V = Vo ( 1 + K At )
V = Volumen inicial
Vo = Volumen final
K = Coeficiente de dilatación cúbica del liquido
At = Incremento de temperatura = (tf - to)
DILATACION TERMICA EN CUERPOS CON ESTADO GASEOSO
Dilatación Gaseosa : Experimentalmente se comprueba que la dilatación térmica de los gases no depende de su naturaleza, es decir, todos los gases experimentan el mismo incremento de volumen con un mismo incremento de temperatura
El coeficiente de dilatación de los gases, œ , es el mismo para todos ellos y su valor es :
œ = 1 / 273
El valor del volumen final de un gas que ha experimentado un incremento de temperatura At se calcula apartir de la siguiente expresión :
V = Vo ( 1 + œ At )
V = Volumen final
Vo = Volumen inicial
œ = Coeficiente de Dilatación de los Gases
Escalas con que se mide el calor

CELSIUS: fue establecida en 1729 por el biólogo sueco anders celsius, se llama centigrada porque hay 100 divisiones entre sus dos puntos extremos, un de ellos es 0°c "punto de congelación del agua y nivel del mar", y el otro extremo es 100°c "punto de ebullición del , a nivel del mar".
FAHRENHEIT: fue establecida por Gabriel Daniel Fahrenheit quien en 1742 construyo el primer termómetro. la escala Fahrenheit se emplea en los países anglosajones para medidas no científicas y en ella el punto de congelación del agua se define como 32 °f y su punto de ebullición como 212 °f.
KELVIN: es la escala termodinámica de temperaturas más empleada, el cero se define como el cero absoluto de temperatura, es decir, -273,15 °c. la magnitud de su unidad, llamada kelvin y simbolizada por k, se define como igual a un grado celsius. fue establecida por convenio , es la unidad de temperatura dl sistema internacional de unidades. inventada por el matemático y físico británico William Thompson lora kelvin. en esta escala el cero es la temperatura a la cual cesa la actividad cinética molecular y la temperatura más pequeña que se puede medir.
El punto triple del agua
es aquel en el cual consiste en equilibrio el esta do solido, el estado liquido y el estado gaseoso de una sustancia. se define con una temperatura y una presión de vapor. el punto triple del agua se da cuando tiene una temperatura constante con una presión de vapor se equilibran.
"EL CERO ABSOLUTO"
es la temperatura mas baja posible. a esta temperatura el nivel de energía del sistema es el mas bajo por lo que las partículas, según la mecánica cuántica, el cero absoluto debe tener una energía residual, llamada energía de punto cero, para poder así cumplir de la indeterminación de Heidelberg. el cero absoluto sirve de punto de partida tanto para la escala de kelvin como para la escala de Rankin. el cero absoluto se logra cuando deseamos medir una temperatura que esta por debajo de 0°c.
Formas de propagación del calor
La energía calorífica se transmite de unos cuerpos a otros por efecto de una diferencia de temperatura. Se puede propagar por conducción, convección y radiación.
"CONDUCCION"
De manera general en los sólidos es la forma como viaja el calor, por su conductividad térmica, se clasifican en conductores o aislantes y son los metales los mejores conductores.
EJEMPLOS:
- Cuando se calienta un sartén, el flujo de calor en el se propaga hasta el mango por conducción.
- En los sólidos como una barrilla de fierro, si se calienta el calor se propaga por conducción.
- Las paredes de una están construidas de metales que estos tienen conductividad térmica constante y no dependen de posicion o de temperatura.
"CONVECCION"
cuando en influido existen dos extremos con temperatura diferente, como en un vaso con agua caliente al que se agrega agua fría, el agua caliente sube produciendo corrientes llamadas de convección, las cuales desplaza a las masas de agua fría hasta que la temperatura se equilibra.
EJEMPLOS:
- Al calentar un líquido apreciamos un movimiento: la parte caliente se mueve hacia arriba y la fría hacia abajo, esto se debe a la convección.
- Otro ejemplo seria el refrigerador: la sustancia circula por los conductores, el color azul nos indica la temperatura baja y el rojo la temperatura alta.
- Las corrientes de convección forzada hacen que circule el agua caliente y que se regrese al , la habitación se calienta debido a las corrientes de convección natural en el aire.
"RADIACION"
cuando el calor se transporta por ondas electromagnéticas incluso, a través del vacio puede viajar. es el caso de la radiación infrarroja y ultravioleta, del calor que del sol que viaja junto a la luz solar. todos los cuerpos irradian calor, y los cuerpos de color blanco lo rechazan y los de color negro lo absorben.
EJEMPLOS:
- El foco también emite calor en forma de radiación por medio de ondas de luz.
- En el vacio y a veces en algunos gases como el , la energía calorífica se propaga por radiación.
- La luz que nos llega del sol transporta calor o energía por medio de radiación.

Unidades de medida de calor
La unidad de medida del calor en el sistema internacional de unidades es la misma que la de la energía y el trabajo "el joule"
1J=4° CAL.
Otra unidad de medida ampliamente utilizada para la cantidad d energía térmica intercambiada es la "caloría", que es la cantidad de energía que hay que suministrar a un gramo de agua y la atmosfera de presión para elevar su temperatura 1c". La caloría también es conocida como caloría pequeña, en comparación con la kilocaloría que se conoce como caloría grande y es utilizada en nutrición.
1 CAL=4.184 J.
¿QUE SE ENTIENDE POR CALORIA Y BTU?
LA CALORIA: es la cantidad de energía que hay que suministrar a un gramo de agua a una atmosfera de presión para elevar su temperatura a 1c´. La caloría también es conocida como caloría pequeña.
EL BTU: es una unidad de energía inglesa, esta se usa principalmente en los estados unidos y esta se va derivando del cero absoluto.
1BTU=1059 J.
Dilatación de los cuerpos
Es un fenómeno asociado con el aumento de temperatura de los cuerpos, la magnitud de este efecto depende del tipo de material. el agua es un caso por que cuando se solidifica su volumen aumenta. la dilatación se da cuando un cuerpo se ve sometido a un cambio de temperatura, sus dimensiones cambian a esto se debe la dilatación, hay 3 formas de dilatación: lineal, superficial y volumétrica.
"DILATACION LINEAL"
Si un cuerpo como un alambre, barrilla o cable se calienta, experimenta un alargamiento el cual es proporcional a la longitud inicial y al cambio de temperatura.
EJEMPLO:
- Al construir las vías del tren se deja un espacio entre las vías para permitir su dilatación lineal.

En la tabla se muestran los coeficientes de dilatación lineal de algunas sustancias sólidas, expresados en ºC°
"DILATACION SUPERFICIAL"
Se define como el incremento de área de un objeto provocado por el incremento de temperatura. Ejemplo:
- La placa metálica de la plancha al calentarse experimenta una dilatación superficial.
"DILATACION VOLUMETRICA"
Se considera un bloque de cualquier sustancia su volumen varia de manera proporcional al cambio de temperatura. Ejemplo:
- El agua es un caso especial por que cuando se solidifica aumenta su volumen.
CAMBIOS PROVOCADOS POR EL CALOR Y TRANSMICION
Historia del calor.
Hace mucho tiempo se creía que le calor era un fluido invisible e imponderable llamado calórico, que se producía cuando una sustancia se quemaba y que podía trasmitirse por conducción de una cuerpo a otro. Se pensaba que cuando dos cuerpos estaban en contacto, el de mayor temperatura cedía calórico al cuerpo de menor temperatura, así definieron el calor en términos de los cambios de temperatura producidos en un cuerpo durante el calentamiento. El abandono de esta teoría forma parte del avance general de la física durante los siglos XVlll y XlX.
¿Qué es el calor?
El calor es una forma de energía que se transfiere entre un sistema y su entorno o entre un sistema y otro debido a una diferencia de temperatura entre ambos, donde la energía fluye del sistema de mayor temperatura hacia el de menor temperatura.
 La teoría de la cinética dice que la materia está constituida por partículas moleculares que se encuentran en constate movimiento. Y puesto que el calor se asocia con el cambio de temperatura y esta a su vez se relaciona con la energía molecular interna de una sustancia, se puede concluir que el calor es una forma de energía: energía térmica que fluye de un sistema de mayor temperatura a otro de menor temperatura.
La teoría de la cinética dice que la materia está constituida por partículas moleculares que se encuentran en constate movimiento. Y puesto que el calor se asocia con el cambio de temperatura y esta a su vez se relaciona con la energía molecular interna de una sustancia, se puede concluir que el calor es una forma de energía: energía térmica que fluye de un sistema de mayor temperatura a otro de menor temperatura.
Así que la temperatura no es una medida de calor de un cuerpo, es energía interna que se incrementa cuando aumenta la temperatura. La variación en la energía interna de un cuerpo no solo se da por el suministro de calor, también se puede dar por acción de otras formas de energía.
Pero es importante que hagamos una distinción mayor entre energía interna y calor. Energía interna es toda la energía de un sistema que está asociada con sus componentes microscópicos, átomos y moléculas, cuando se ve desde unmarco de referencia en reposo con respecto al centro de masa del sistema.
Y el calor como anteriormente ya lo había planteado se define como la transferencia de energía a través de la frontera de un sistema debido a la diferencia de temperatura entre el sistema y su entorno.
Unidades de calor.
Las primeras nociones de calor basadas en el calórico sugerían que el flujo de este fluido de una sustancia a otra causaba cambios en la temperatura. Del nombre de este mítico fluido tenemos una unidad de energía relacionada conproceso térmico, la caloría (cal), que se define como la cantidad de trasferencia de energía necesaria para elevar la temperatura de 1 g de agua de 14.5 °C a 15.5°C. La unidad de energía en el sistema convencional en estado unido es la unidad térmica británica (Btu), que se define como la cantidad de trasferencia de energía necesaria para elevar la temperatura de 1Lb de agua de 63°F a 64°F.
Dilatación.
Casi todos los materiales se expanden al aumentar la temperatura. Los cambios de temperatura por lo regular traen consigo cambios en las dimensiones de los cuerpos, ya sean sólidos, líquidos o gases.
Al aumentar su temperatura, el movimiento de sus partículas se vuelven más rápido y se incrementa la separación entre ellas, lo que hace que se expandan. A este fenómeno se le llama dilatación.
Los gases se dilatan mucho más que los líquidos ya que Las uniones entre las moléculas de los gases son las menos fuertes y las que más se dilatan en presencia de calor; les siguen los líquidos y por último, los sólidos.
Existen tres tipos de dilatación: lineal, superficial o volumétrica.
Dilatación lineal.
La dilatación lineal es el incremento en la longitud de un material debido a un aumento en su temperatura. En muchos casos, la variación en las dimensiones de un sólido es imperceptible a simple vista; en algunos otros, es posible observarlo.
¿Pero cómo es posible que la longitud aumente por efecto de la temperatura?
Pues imagina que tienes una liga elástica y la estiras, ¿Qué sucede? Se incrementan las dimensiones. Algo similar pasa con los materiales que sufren cambios por temperatura: se incrementa su longitud. La fuerza es el equivalente a la diferencia de temperatura que provoca un cambio en las dimensiones de los materiales.
Suponga que una varilla de material tiene una longitud Lo a una temperatura inicial de To. Si la temperatura cambia en ΔT, la longitud cambia en ΔL. Introduciendo una constante de proporcionalidad α (diferente para cada material).
Pare el caso de un sólido, que tiene una forma definida, la expansión térmica puede analizarse en términos de las dimensiones específicas del objeto. El cambio en cualquier dimensión de un sólido se denomina expansión térmica lineal. Para cambios de temperatura relativamente pequeños, se ha encontrado experimentalmente que el cambio ΔL en cualquier dimensión lineal de un sólido es proporcional al el cambio de temperatura ΔT. Podemos expresar estas relaciones en una ecuación:
ΔL= α Lo ΔT
Donde:
Δl= cambio de longitud
α= constante de proporcionalidad y se denomina coeficiente de expansión térmica lineal del material
lo= longitud inicial
ΔT= incremento de temperatura (T2-T1)
La constante α, que describe las propiedades de expansión térmica de un material, se denomina coeficiente de expansión lineal.
Material
|
Coeficiente de expansión lineal (º C –1)
|
Aluminio
|
24 x 10-6
|
Latón y bronce
|
19 x 10-6
|
Cobre
|
17 x 10-6
|
Vidrio (ordinario)
|
9 x 10-6
|
Vidrio (Pirex)
|
3,2 x 10-6
|
Plomo
|
29 x 10-6
|
Acero
|
11 x 10-6
|
Invar(aleación de Níquel – Cromo)
|
6,9 x 10-6
|
Concreto
|
12 x 10-6
|
Ejemplo.
Una de las ciudades más calurosas de la república mexicana es Hermosillo, sonora. Su una días de verano amanece a una temperatura de 25°C y alrededor de las 15:00 p.m. se eleva a 40°C, ¿Cuál será el incremento de longitud en cm de un cable de alta tensión de acero a 200m?
Datos e incógnita
|
Formula
|
Sustitución y resultado
|
T1= 25°C
|
Δl= Δlo ΔT
|
Δl= (11.5x10 ala -6 1/°C) (200 m)(40°C -25°C)
|
T2=40°C
|
Δl= αlo (T2-T1)
|
Δl= (11.5x10 ala -6 1/°C)(200 m)(15°C)
|
Lo= 200m
|
Δl= 3.45 cm
| |
α= 11.5x10 ala -6
|
Δl= 1.03 cm
| |
Δl= ?
|
Dilatación superficial.
Puesto que las dimensiones de un objeto cambian de temperatura, tal como se estudio en la sección anterior, se deduce que su área también se altera. Así que la dilatación superficial es la expansión de un cuerpo en dos dimensiones y se expresa por la ecuación:
ΔA= 2αAoΔT
ΔA= incremento de área
Ao=Área del objeto antes de su dilatación.
Δt= diferencia de las temperatura (t2-T1)
2α= γ
Este último se conoce como el coeficiente medio de expresión de área o dilatación superficial; se puede obtener multiplicando el coeficiente de dilatación térmica por dos.
El fenómeno de dilatación superficial se presenta, por lo general en placas metálicas o en láminas muy delgadas, donde podemos apreciar su espesor.
En estas placas metálicas, al aplicarles calor se produce una expansión de su superficie o área, es decir, crecen un poco.
En estas placas metálicas, al aplicarles calor se produce una expansión de su superficie o área, es decir, crecen un poco.
Ejemplo.
Si el coeficiente de dilatación lineal del oro es de 14.2x10 ala -6 1/°C ¿Cuál será el coeficiente de dilatación superficial?
Datos
|
solución
|
α= 14.2x10 ala -6 1/°C
|
2α= γ= 2(14.2x10 ala -6 1/°C)
|
γ= 28.4x10 ala -6 1/°C
|
Dilatación volumétrica.
Además de la dilatación lineal y superficial, también se puede dar el caso de la dilatación volumétrica. Es aquella en que predomina la variación en tres dimensiones, o sea, la variación del volumen del cuerpo.
Al enfriarse el agua desde la temperatura ambiente hasta 4°C, se contrae o disminuye su volumen, como es de esperarse, pero al enfriarse desde 4°C hasta el punto de congelación (0°C), el agua se expande. Inversamente cuando el agua se calienta desde 0°C hasta 4°C se contrae y, por encima de 4°C, se expande.
El incremento de volumen de un cuerpo puede calcularse mediante la expresión matemática:
ΔV= βVoΔT
Donde:
ΔV= incremento de volumen (V2-V1)
β = coeficiente de expansión volumétrica (es igual a 3α)
Vo= volumen inicial (antes de la dilatación)
ΔT= incremento de temperatura (T2-T1)
Donde β es el coeficiente promedio de expansión de volumen. Para un sólido, el coeficiente promedio de expansión en volumen es tres veces el coeficiente promedio de expansión lineal: β = 3α.
Material
|
Coeficiente de expansión volumétrico ( º C -1)
|
Alcohol etílico
|
1,12 x 10-4
|
Benceno
|
1,12 x 10-4
|
Acetona
|
1,5 x 10-4
|
Glicerina
|
4,85 x 10-4
|
Mercurio
|
1,82 x 10-4
|
Trementina
|
9 x 10-4
|
Gasolina
|
9,6 x 10-4
|
Aire a 0 º C
|
3,67 x 10-4
|
Helio a 0 º C
|
3,665 x 10-4
|
Ejemplo.
Un vaso de agua de 250 ml se llena con agua caliente a 70°C.
¿Cuál es el decremento en volumen si la temperatura desciende a 20°C?
Datos e incógnita
|
formula
|
T1= 70°C
|
ΔV= βVoΔT
|
T2= 20°C
| |
Vo= 250 ml =250 cm³
| |
Β= 0.21X10 ala -3 1/°C
| |
V2= ?
|
Sustitución y resultado.
ΔV= (0.21x10 ala -3 1/°C)(250 cm³)(20°C-70°C)
ΔV= -2.6 cm³
LEYES DE LOS GASES
En esta ley se incluye a tres grandes científicos los cuales aportaron diversas experimentaciones para el descubrimiento de estas leyes Charles, Boyle y Lussac
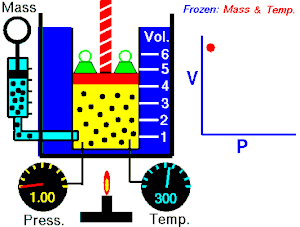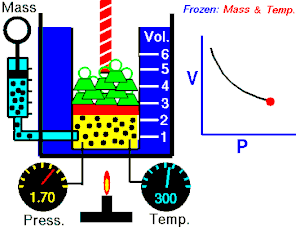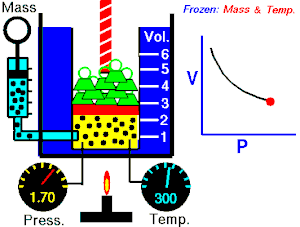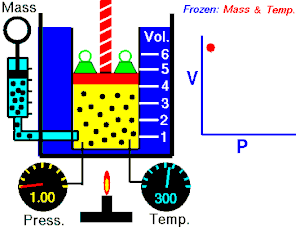
Ley de Boyle-Mariotte
La Ley de Boyle-Mariotte, o Ley de Boyle, formulada independientemente por el físico y químico irlandésRobert Boyle (1662) y el físico y botánico francés Edme Mariotte (1676),
es una de las leyes de los gasesque relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante.
La ley dice que:
La presión ejercida por una fuerza física es inversamente proporcional al volumen de una masa gaseosa, siempre y cuando su temperatura se mantenga constante.
o en términos más sencillos:
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que este ejerce.
Matemáticamente se puede expresar así:
donde  es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
 es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
 para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
donde:
Además, si se despeja cualquier incógnita se obtiene lo siguiente:

Esta ley es una simplificación de la ley de los gases ideales o perfectos particularizada para procesos isotérmicos de una cierta masa de gas constante.
Junto con la ley de Charles, la ley de Gay-Lussac, la ley de Avogadro y la ley de Graham, la ley de Boyle forma las leyes de los gases, que describen la conducta de un gas ideal. Las tres primeras leyes pueden ser generalizadas en la ecuación universal de los gases.
Experimento de Boyle
Para poder verificar su teoría introdujo un gas en un cilindro con un émbolo y comprobó las distintas presiones al bajar el émbolo. A continuación hay una tabla que muestra algunos de los resultados que obtuvo este fenómeno:
-
Experimento de Boyle × P (atm) V (L) P · V 0,5 60 30 1,0 30 30 1,5 20 30 2,0 15 30 2,5 12 30 3,0 10 30
Si se observan los datos de la tabla se puede comprobar que al aumentar el volumen, la presión disminuye. Por ello se usa una diagonal isotérmica para representarlo en una gráfica. 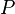 , aumenta y que al multiplicar
, aumenta y que al multiplicar 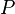 y
y  se obtiene
se obtiene  atm·L.
atm·L.
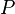 , aumenta y que al multiplicar
, aumenta y que al multiplicar 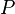 y
y  se obtiene
se obtiene  atm·L.
atm·L.Ecuación general del estado gaseoso
La combinación de la Ley de Boyle y la Ley de Charles nos permite establecer una relación matemática entre el volumen, temperatura y presión de una muestra determinada de gas. Esta relación queda formulada así:
"La razón entre el producto Presión - Volumen y la Temperatura es una constante".
esta masa gaseosa puede expresarse en términos de una condición inicial y una condición final:
que representa la ecuación general del estado gaseoso y en ella están incluídos los tres parámetros que determinan el comportamiento de los gases, donde:
P se expresa en atm, mmHg o psig
T se expresa en kelvins
V se expresa en litros, sus múltiplos y submúltiplos, cm3.
Ejemplo 1:
Un volumen de 100 cm3 de un gas en condiciones normales de temperatura y presión (1 atm y 0 °C), si queremos que ocupe el volumen de 1 litro a la presión de 590 mm Hg ¿A qué temperatura en °C debemos someterlo?
Análisis de los datos y resolución
Es un caso de variación de los tres parámetros (volumen, presión y temperatura) en un gas, desde unas condiciones iniciales hasta unas condiciones finales. Aplicaremos la ecuación general del estado gaseoso. Las unidades de volumen son consistentes, las unidades de presión de la condición inicial debe convertirse a mm Hg.
Los cálculos de temperatura se hacen siempre en kelvins y al final convertimos a °C.
Despejando T2 de la ecuación general del estado gaseoso:
Como puedes observar, debemos ser consistentes en las unidades a usar para hacer los cálculos.






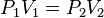


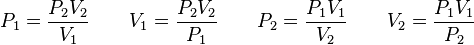
No hay comentarios:
Publicar un comentario